ISAC | 流式细胞技术在支原体检测与分离问题中的创新应用
2025-04-08 支撑成果
支原体(Mycoplasma)是细胞培养中常见的污染源,其微小的体积(300-800 nm)和缺乏细胞壁的特性使其结构具有可塑性,常见的除菌过滤装置无法将其有效清除。支原体污染不仅会导致细胞增殖抑制、DNA片段化和凋亡,还可能影响实验结果的准确性,甚至导致错误结论。传统的检测方法如微生物培养、DNA染色和PCR虽然有效,但在灵敏度和实效性上存在局限。
深圳湾实验室生化分析平台通过流式细胞技术成功攻克了支原体污染检测与分离这一技术难题。开发了一种基于Hoechst和CFSE双染料标记的流式检测与分离技术,通过将触发阈值从默认的前向散射(FSC)切换到Hoechst Blue通道,利用支原体与细胞碎片之间的DNA含量差异实现了精准区分。该方法不仅能够在单细胞水平实时检测支原体污染,还能通过分选获得具有感染活性的支原体,为后续基因表达调控和宿主互作机制研究提供了重要工具。
技术亮点
高效检测:通过Hoechst和CFSE双染,支原体(Hoechst+ CFSE+)与细胞碎片(Hoechst− CFSE+)及背景噪音(Hoechst− CFSE−)清晰分群,灵敏度极高。
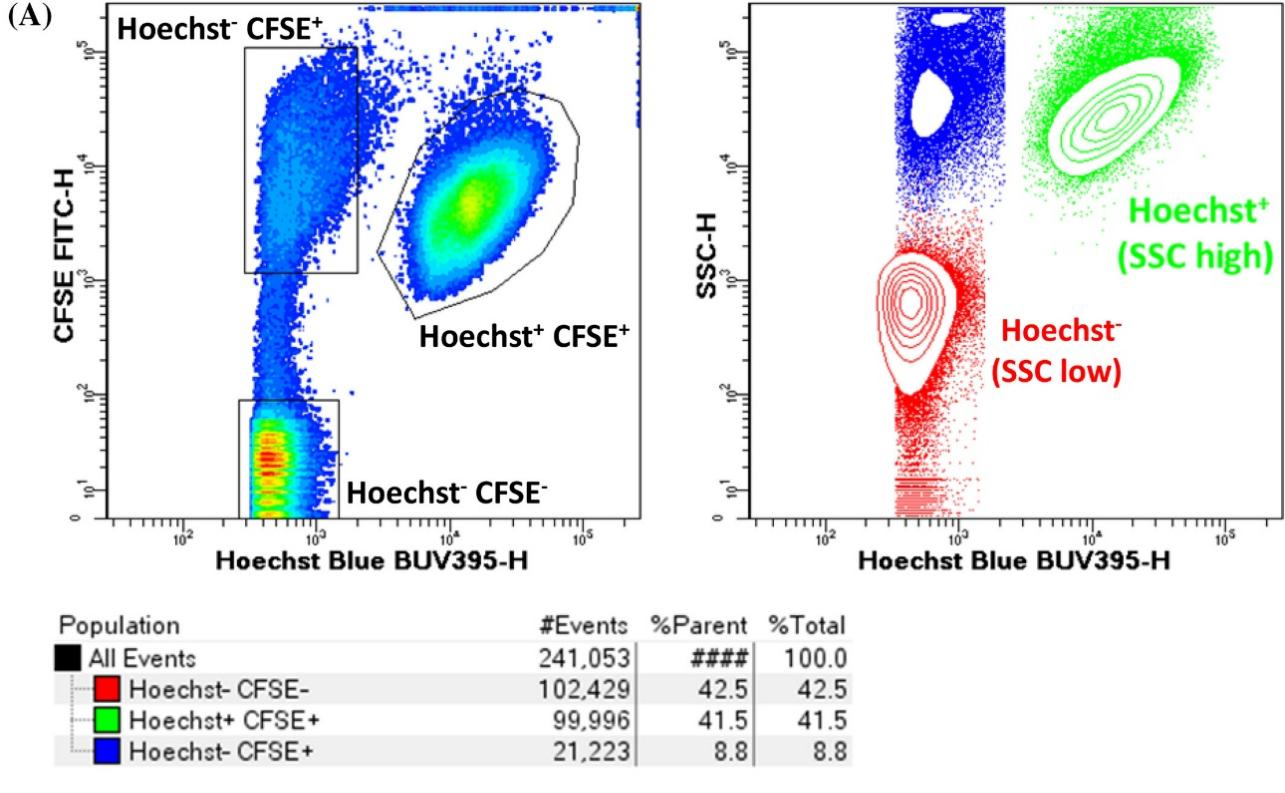
图1 流式检测支原体分群情况。Hoechst− CFSE+群、Hoechst− CFSE+群和 Hoechst− CFSE−群。
实时定量:流式细胞技术可实时监测支原体浓度,为药理学研究中抗生素药效评估提供量化依据。

图2 使用支原体清除试剂Myco-Off Mycoplasma Cleaner处理污染的细胞。(A)支原体浓度在第0天和第4天的变化。(B)共聚焦显微镜检查Hoechst和WGA染色的细胞。
分离纯化:分选后的支原体仍保持感染活性,可用于进一步基因表达调控以及与宿主互作的机制研究。
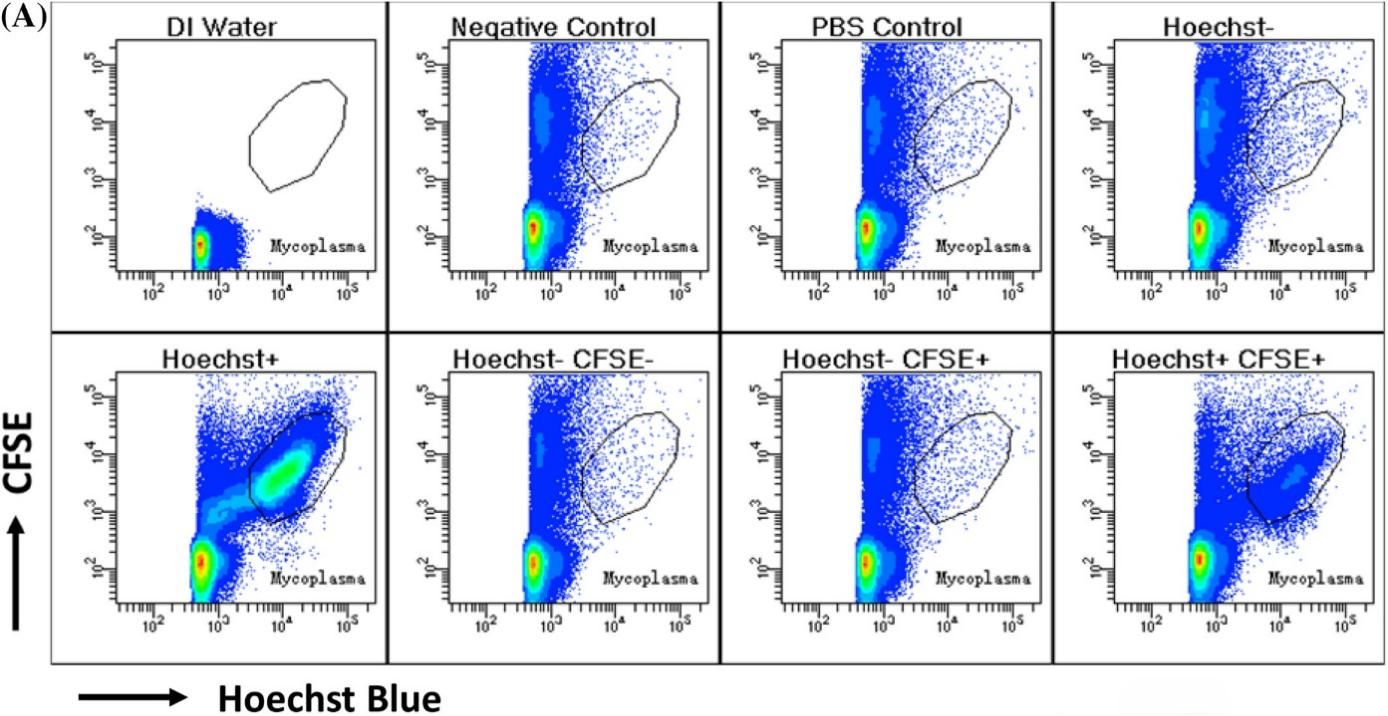
图3 分选后的支原体感染指示细胞A549后,取上清液对支原体进行检测。
实验验证
我们通过聚合酶链式反应(PCR)和冷冻电镜(cryo-EM)验证了流式细胞分选结果的准确性。实验表明,分选后的支原体在指示细胞中仍能繁殖并表现出感染特性,证明了该方法的有效性。

图4 (B)PCR和(C)cryo-EM验证支原体。
该方法已发表在国际流式协会(International Society for Advancement of Cytometry)期刊 Cytometry Part A,题为“Flow cytometry-based method to detect and separate Mycoplasma hyorhinis in cell cultures”。论文的第一作者为深圳湾实验室、深圳医学科学院和西湖大学联合培养博士生刘春镯,通讯作者为深圳湾实验室生物影像平台工程师刘珊博士和生化分析平台工程师李梦元。本研究得到深圳湾实验室分子生理学研究所邓麟课题组的技术支持!
